Alcoholes
Usos
Los alcoholes están ampliamente distribuidos en la naturaleza y tienen muchas aplicaciones industriales y farmacéuticas. El etanol , por ejemplo, es una de las sustancias orgánicas más simples y mejor conocidas, y se usa como aditivo de combustibles, como solvente industrial y en bebidas; el mentol , un alcohol aislado de la menta, se usa mucho como saborizante y en perfumería; y el colesterol , un alcohol esteroide cuya fórmula tiene aspecto complicado, se considera un agente que causa enfermedades del corazón.
DEFINICIÓN
Los alcoholes son compuestos orgánicos que contienen grupos funcionales hidroxilo (-OH) unidos a hidrocarburos (grupos R)con hibridación sp3.
Los grupos hidroxilo en los alcoholes tienen una geometría angular que les permite formar interacciones de enlaces de hidrógeno con otros alcoholes y moléculas de agua; esto explica el punto de ebullición relativamente alto de los alcoholes y su solubilidad en agua. El siguiente diagrama muestra la estructura química de los alcoholes y la formación de interacciones de enlaces de hidrógeno.
Clasificación de los alcoholes
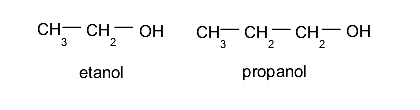
Monoalcoholes o alcoholes. Estos contienen un solo grupo hidroxilo.Ejemplo:
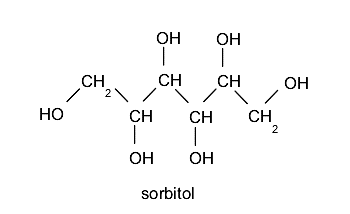
Polialcoholes o polioles. Contienen más de un grupo hidroxilo. Ejemplo:
Otra forma de clasificar los alcoholes es según la posición del carbono al cual está enlazado el grupo hidroxilo, teniendo en cuenta también a cuántos átomos de carbono está enlazado además este carbono:
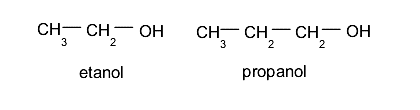
- Alcoholes primarios. El grupo hidroxilo (-OH) se ubica en un carbono enlazado a su vez a otro único átomo de carbono. Por ejemplo:
- Alcoholes secundarios. El grupo hidroxilo (-OH) se ubica en un carbono enlazado a su vez a otros dos átomos de carbono distintos. Por ejemplo:
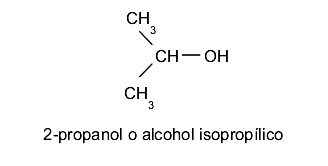
- Alcoholes terciarios. El grupo hidroxilo (-OH) se ubica en un carbono enlazado a su vez a otros tres átomos de carbono distintos. Por ejemplo:
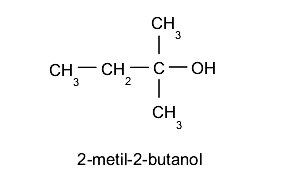
NOMENCLATURA
El método IUPAC para nombrar alcoholes es simple. Podemos generalizarlos en 3 pasos:
- Encuentra la cadena de carbono más larga.
- Numere los átomos en la cadena de carbono más larga, comenzando con el extremo más cercano al grupo hidroxilo (-OH).
- Para nombrar un alcohol, identifique el número atómico con el grupo hidroxilo (-OH) seguido del prefijo correspondiente al número de átomos de carbono de la cadena más larga, seguido del sufijo "-ol".
- Los alcoholes suelen ser líquidos incoloros con un olor característico.
- Son solubles en agua, pero presenta menos densidad que ella.
- Tienen forma geométrica.
Mientras más alta es su masa molecular más altos serán sus puntos de ebullición y fusión, llegando a ser sólidos a temperatura ambiente.
La presencia del grupo hidroxilo permite que las moléculas sean solubles en agua ya que forman puentes de hidrógeno.
PROPIEDADES QUÍMICAS
- Los alcoholes se pueden comportar como ácidos o bases debido a la presencia de su grupo funcional similar al agua, que establece un dipolo muy parecido al que presenta la molécula de agua.
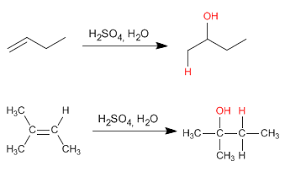
Hidratación de alquenos.
Esta reacción es catalizada por ácido( H2SO4,H3PO4) y cumple con la regla Markovnikov. Se utiliza principalmente en la industria para obtener etanol, y son propanol.
Hidrólisis de haluros de alquilo.
Es realizada por medio de una reacción de sustitución nucleofílica donde se forma el alcohol una sala orgánica.
Reacciones de reducción:
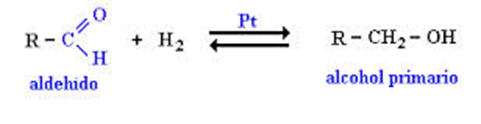
3.1Hidrogenación catalítica.
3.1.1 Reducción de aldehído
Forma un alcohol primario
3.1.2 reducción de una cetona
Forma un alcohol secundario
3.1.3 Alcoholes terciarios
No se reducen.
3.2 Hidruro de Litio y Aluminio
3.2.1 Reducción de aldehído.
Forma un alcohol primario
3.2.2 Reducción de una cetona.
Forma un alcohol secundario
3.2.3 Alcoholes terciarios
No se reducen.
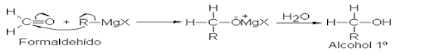
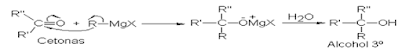
Reactivo de Grignard.
4.1 Formación de alcohol primario
4.2 Formación de alcohol secundario
4.3 Formación de alcohol terciario
Oxidación de alquenos.
5.1 Sin ruptura de enlace Sigma
Reacciones
Reacciones de oxidación
Prueba de Lucas
El reactivo de Lucas(HCl y ZnCl2) Identifica los alcoholes terciarios y secundarios.
SecundariosPrimarios
Deshidratación de ácido sulfúrico
Bibliografía
McMurry, J. (2008). Química orgánica. México: PEARSON EDUCACIÓN.
Yurkanis, P. (2007). Fundamentos de Química orgánica. México: PEARSON EDUCACIÓN.






















Comentarios
Publicar un comentario